DrVeto et le règlement européen 2019/6
Qu'est-ce que le règlement européen 2019/6 ?
Le règlement européen 2019/6, entré en vigueur le 28 janvier 2022, a pour but d’adapter le cadre réglementaire applicable aux médicaments vétérinaires aux nouveaux enjeux de la pharmacie vétérinaire tout en continuant à assurer un niveau élevé de protection de la santé animale et publique, et de l’environnement.
Ce nouveau règlement vise à améliorer l’accès et le partage des informations sur les médicaments destinés aux animaux qu’ils soient de compagnie et d’élevage.
L'impact du règlement européen sur les vétérinaires.
L’article 57 traite de la collecte des données relatives aux médicaments antimicrobiens utilisés chez l’animal avec un calendrier progressif pour les espèces animales concernées. Cette collecte est reprise dans le projet Calypso porté par le CNOV et dans ce cadre, un fichier officiel de l’ensemble des médicaments vétérinaires autorisés en France doit être fourni par l’ANMV. Cela fera partie d’une prochaine version de DrVeto avec son lot de nouvelles obligations.
Les articles 103 à 118 traitent de la vente au détail et de l’utilisation des médicaments vétérinaires. L’impact majoritaire du règlement européen 2019/06 pour les vétérinaires est que de nouvelles règles apparaissent pour la prescription des médicaments vétérinaires avec une ordonnance qui doit comporter plusieurs nouvelles mentions.
Pour la rédaction de l’ordonnance, c’est le paragraphe 5 de l’article 105 qui s’applique.
- Une ordonnance vétérinaire comporte au moins les éléments suivants:
a) l’identification de l’animal ou des groupes d’animaux à traiter;
b) le nom complet et les coordonnées du propriétaire ou du détenteur de l’animal;
c) la date de délivrance;
d) le nom et les coordonnées du vétérinaire, y compris, le cas échéant, le numéro professionnel;
e) la signature ou une forme électronique équivalente d’identification du vétérinaire;
f) le nom du médicament prescrit, y compris ses substances actives;
g) la forme pharmaceutique et le dosage;
h) la quantité prescrite, ou le nombre d’emballages, y compris leur taille;
i) le schéma posologique;
j) pour les espèces animales productrices de denrées alimentaires, le temps d’attente, même si ce temps d’attente est nul;
k) toutes les mises en garde nécessaires pour assurer la bonne utilisation, y compris, le cas échéant, pour assurer un usage prudent des antimicrobiens;
l) si un médicament est prescrit conformément aux articles 112, 113 et 114, une déclaration à cet effet;
m) si un médicament est prescrit conformément à l’article 107, paragraphes 3 et 4, une déclaration à cet effet.
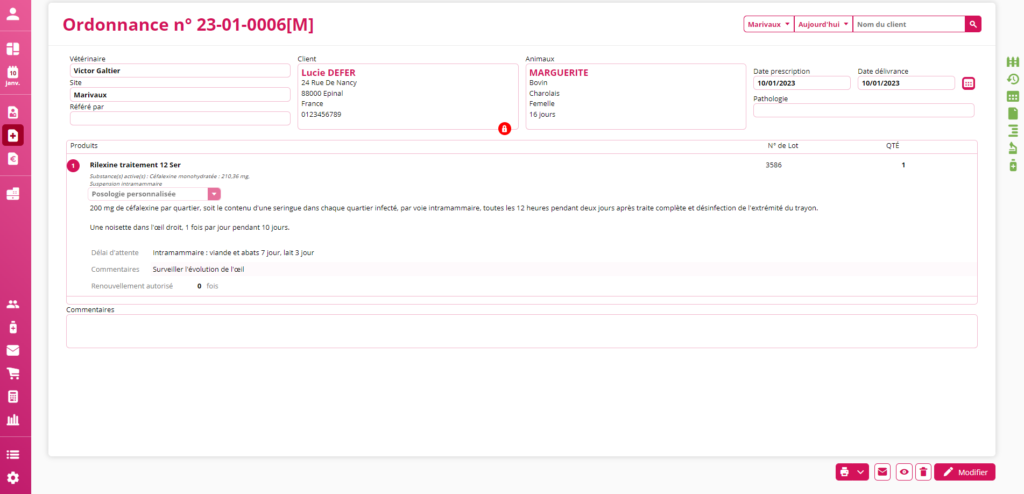
L’ordonnance vétérinaire s’en trouve donc alourdie car elle doit, pour chaque médicament, donner un lot d’informations conséquent.
DrVeto facilite la mise en place du règlement européen sur l'ordonnance.
L’équipe de DrVeto se base sur le fichier de l’ANMV afin de recueillir toutes les données nécessaires à la bonne rédaction des ordonnances et ainsi essayer de faciliter la vie au quotidien des vétérinaires tout en respectant les nouvelles règles édictées (voir notre documentation).
Les informations supplémentaires, telles que les substances actives, la forme pharmaceutique et le dosage sont directement inscrites dans l’ordonnance sans que vous ayez à intervenir et ne sont pas modifiables.
Une autre information importante devant figurer sur l’ordonnance (alinéa l) est l’indication de la prescription hors cadre de l’AMM ou plus communément appelée loi de la cascade (utilisation pour une pathologie et/ou pour une espèce différente de celle prévue dans l’AMM). Ce sont les articles 112, 113 et 114 qui gèrent cette cascade.
Sur DrVeto Windows et Cloud, il est possible de visualiser cette partie de RCP de façon à vérifier les pathologies, les espèces et les délais d’attente prévus par le fabricant. Une nouvelle rubrique doit être saisie de façon à notifier cette utilisation hors cadre de l’AMM pour chaque ligne de l’ordonnance. Il n’y a rien à saisir si c’est dans le cadre de l’AMM.
D’autre part, cette utilisation hors cadre de l’AMM entraîne potentiellement une modification des temps d’attente dont les nouvelles règles d’établissement sont données dans l’article 115 du RE 2019/6 dont un extrait suit :
- Aux fins des articles 113 et 114, à moins que le résumé des caractéristiques du médicament utilisé ne spécifie le temps d’attente pour l’espèce animale en question, un temps d’attente est fixé par le vétérinaire conformément aux critères suivants:
a) pour les viandes et les abats provenant de mammifères et de volailles et de gibier d’élevage à plumes producteurs d’aliments, le temps d’attente n’est pas inférieur:
i) au temps d’attente le plus long prévu pour la viande et les abats dans le résumé des caractéristiques du produit, multiplié par 1,5;
ii) à vingt-huit jours si le médicament n’est pas autorisé pour les animaux producteurs de denrées alimentaires;
iii) à un jour si le temps d’attente pour le médicament donné est nul et que ce médicament est utilisé chez des animaux d’une famille taxinomique autre que les espèces cibles autorisées;
b) pour le lait provenant d’animaux producteurs de lait destiné à la consommation humaine, le temps d’attente n’est pas inférieur:
i) au temps d’attente le plus long pour le lait prévu dans le résumé des caractéristiques du produit pour n’importe quelle espèce animale, multiplié par 1,5;
ii) à sept jours si le médicament n’est pas autorisé pour les animaux producteurs de lait destiné à la consommation humaine;
iii) à un jour si le temps d’attente pour le médicament donné est nul;
c) pour les œufs provenant d’animaux producteurs d’œufs destinés à la consommation humaine, le temps d’attente n’est pas inférieur:
i) au temps d’attente le plus long pour les œufs prévu dans le résumé des caractéristiques du produit pour n’importe quelle espèce animale, multiplié par 1,5;
ii) à dix jours si le produit n’est pas autorisé pour les animaux producteurs d’œufs destinés à la consommation humaine;
d) pour les espèces aquatiques productrices de viande destinée à la consommation humaine, le temps d’attente n’est pas inférieur:
i) au temps d’attente le plus long prévu pour l’une des espèces aquatiques mentionnées dans le résumé des caractéristiques du produit, multiplié par 1,5 et exprimé en degrés-jours;
ii) si le médicament est autorisé pour les espèces animales terrestres productrices d’aliments, au temps d’attente le plus long prévu pour l’une des espèces animales productrices d’aliments mentionnées dans le résumé des caractéristiques du produit, multiplié par 50 et exprimé en degrés-jours, sans dépasser 500 degrés-jours;
iii) à 500 degrés-jours si le médicament n’est pas autorisé pour les espèces animales productrices d’aliments;
iv) à 25 degrés-jours si le temps d’attente le plus long pour n’importe quelle espèce animale est nul.
2. Si les résultats du calcul du temps d’attente conformément aux points a) i), b) i), c) i) ainsi que d) i) et ii) du paragraphe 1, s’expriment en fraction de jours, le temps d’attente est arrondi au nombre de jours le plus proche
DrVeto souhaite vous rendre la tâche plus aisée en vous permettant d’adapter les posologies et délais d’attente selon les données fournies par l’ANMV, tout en ajoutant un champ lié aux contre-indications que vous jugerez utiles de renseigner selon les cas.
L’équipe de DrVeto est bien conscient des contraintes supplémentaires occasionnées et essaye au maximum de faire en sorte que le vétérinaire puisse respecter la nouvelle réglementation.
Voici un exemple de résultat final une fois l’ordonnance imprimée.

Qu'est-ce que la prescription dans le cadre de la cascade ?
Tout médicament a une AMM (autorisation de Mise sur le Marché) avec un RCP (Résumé des Caractéristiques du Produit) qui indique comment l’utiliser. Y sont notamment indiquées les espèces chez lesquelles il peut être administré et les pathologies pour lesquelles il est indiqué. Les RCP sont devenus de plus en plus détaillés et les anciens RCP vont être actualisés au fil du temps, entraînant des modifications dans l’usage des médicaments.
Si le vétérinaire décide d’utiliser un médicament hors cadre du RCP, autrement dit dans le cadre de la cascade (utilisation pour une pathologie et/ou pour une espèce différente de celle prévue dans le RCP), il engage sa responsabilité de prescripteur et il doit l’indiquer sur l’ordonnance.
DrVeto et la cascade.
Pour garantir une prescription conforme à la réglementation, DrVeto a décidé de modifier son module « Ordonnance ».
Personne ne peut connaître en détail tous les RCP. C’est pourquoi il est important d’avoir leur actualisation régulière. DrVeto effectuera automatiquement cette mise à jour chaque semaine.
Lors de la saisie d’un médicament, le texte du RCP est systématiquement visualisable. Cela permet de vérifier les espèces, les pathologies et les temps d’attente réglementaires notifiés dans le RCP. Certaines rédactions sont très longues pour évoquer tous les cas d’usage : espèces, indications, précautions d’emploi. Une barre de défilement à droite permet d’en lire l’intégralité. Il est aussi possible de la visualiser dans l’onglet « médical » de la fiche du médicament.
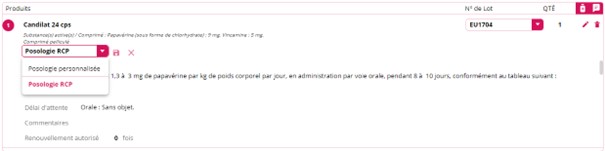
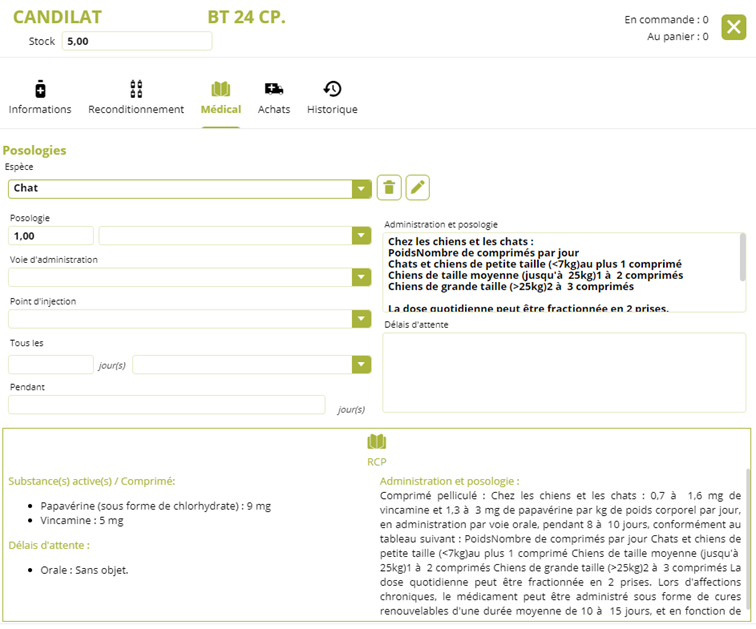
Naturellement, il est possible de créer des posologies personnalisées pour réduire la taille du texte. Une fois rédigée, il est possible de l’enregistrer en cliquant sur le sigle « enregistrement ». Chaque posologie personnalisée est valable pour une espèce. C’est elle qui apparaît par défaut lors de la saisie d’un médicament. Vous pouvez créer toutes ces posologies personnalisées par espèce dès la création du médicament à partir de l’onglet « médical » de sa fiche « produit ».
Comme il n’existe pas de standards pour la rédaction des RCP, il est impossible de créer des règles automatiques depuis le RCP pour indiquer si la prescription est dans le cadre de la cascade. Il faut aussi vérifier les indications d’utilisation. Cette notification de prescription dans le cadre de la cascade doit se faire à partir du bouton « éditer » en bout de ligne de la dénomination du médicament dans l’ordonnance. Pour les animaux de rente, il ne faut pas oublier non plus, si besoin, de changer les valeurs des temps d’attente.
DrVeto est bien conscient des contraintes supplémentaires occasionnées et essaye au maximum de faire en sorte que le vétérinaire puisse respecter la nouvelle réglementation.

